Об особенностях первой российской вакцины от коронавируса, что значит ее временная регистрация, почему ее критикуют в мире и можно ли будет вакцинировать уже переболевших COVID-19, рассказал в интервью агентству Sputnik заместитель директора Центра имени Н. Ф. Гамалеи по научной работе Денис Юрьевич Логунов.
— В прошлое воскресенье вы передали результаты клинических исследований в Минздрав. Сами результаты пока не опубликованы. Расскажите об основных выводах этих исследований.
— Мы провели полный комплекс доклинических исследований безопасности и эффективности вакцины, а затем два клинических исследования, в которых вакцина изучалась с привлечением здоровых добровольцев по показателям безопасности и иммуногенности. Вакцина по результатам этих исследований показала хороший профиль безопасности и высокую иммуногенность. Если брать конкретные показатели и цифры, которые были достигнуты, то средний геометрический титр антител у добровольцев достиг более чем 1 на 14 000, почти 1 на 15 000. И сероконверсия была у ста процентов добровольцев. Что такое сероконверсия — это когда у человека более чем в четыре раза относительно исходных, фоновых значений прирастает титр антител. Также оценивались параметры гуморального иммунитета по реакции нейтрализации вируса, то есть прямой инактивации вируса антителами. У всех добровольцев, проиммунизированных нашей вакциной, были обнаружены вируснейтрализующие антитела и в случае применения сухой, и в случае применения жидкой форм вакцины. Также были проанализированы различные показатели клеточного иммунного ответа, в частности цитотоксические лимфоциты — очень важный параметр противовирусного иммунитета. Цитотоксические лимфоциты, которые удаляют из организма зараженные вирусом клетки, были обнаружены у всех вакцинированных добровольцев. Таким образом, по иммуногенности мы получили очень хорошие результаты. По безопасности: ожидаемые нежелательные явления, которые выражались в виде температуры и боли в месте введения, наблюдались не у всех добровольцев. Но эти конкретные цифры будут опубликованы в ближайшее время.
— Скажите, пожалуйста, какое количество людей приняло участие в испытаниях в первой и второй фазах?
— В первой и второй фазах принимали участие 38 и 38 человек, то есть всего 76. Отличались два протокола тем, что вакцина по действующему веществу была одинаковая, но агрегатная форма была разная. Одна форма лиофильно высушенная, другая — замороженная. Действующее вещество одно, а формы вакцины две. Поэтому и 76 человек.
— А по возрасту насколько отличались участвовавшие?
— Добровольцы для первой и второй фазы набираются из возрастной группы 18-60 лет.
— В международной прессе часто повторяется утверждение, что на создание надежной, безопасной вакцины нужно не меньше полутора лет. Могли бы вы объяснить, как ученым Центра имени Н. Ф. Гамалеи удалось создать вакцину в столь короткие сроки, буквально за пять-шесть месяцев?
— Неправильно говорить, что нам удалось создать вакцину с нуля за короткие сроки. Начиная с момента разработки технологии аденовирусных векторов до ее внедрения в практику прошло уже четыре десятка лет. За эти четыре десятка лет была создана технологическая платформа, которая была апробирована на десятках тысяч людей как на основе вектора пятого серотипа, так и на основе 26-го. Всего с 2015 года вакцинами на основе аденовирусных векторов, разработанными в Центре им. Н. Ф. Гамалеи, было провакцинировано более трех тысяч человек. Поэтому это был не труд пяти месяцев, никоим образом. Это был труд нескольких десятков лет. Вакцины на основе аденовирусных векторов были созданы не только в России. Китай, компания CanSino, и Johnson & Johnson также работают с аденовирусными векторами. В первую очередь это разработки вакцин против лихорадки Эбола. Эти платформы известны и хорошо изучены в рамках клинических испытаний. Помимо результатов клинических испытаний в пользу безопасности данных платформ на основе аденовирусных векторов можно добавить то, что мы все болеем аденовирусами и ни у кого никаких последствий в виде соматических заболеваний никогда не бывает. Американцы провели достаточно большую работу по иммунизации людей аденовирусами четвертого и седьмого серотипа. Они вакцинируют аденовирусами всех новобранцев, которые попадают в армию США. Большое ретроспективное корреляционное исследование на более чем 100 тысячах вакцинированных человек не выявило никаких отклонений. Кроме этого, мы с аденовирусом живем миллионы лет, никаких ассоциаций с соматическими патологиями после аденовирусных инфекций нет. А у нас идет работа не с живыми аденовирусами, а с аденовирусными векторами, это вирусы, у которых удалены части геномов, и они не способны размножаться в клетках человека. Получается, что и с аденовирусами-то нестрашно жить вместе, а с векторами, которые не способны размножаться, совсем безопасно. И мои слова подтверждаются десятками тысяч исследований этих векторов, в том числе множеством клинических исследований.
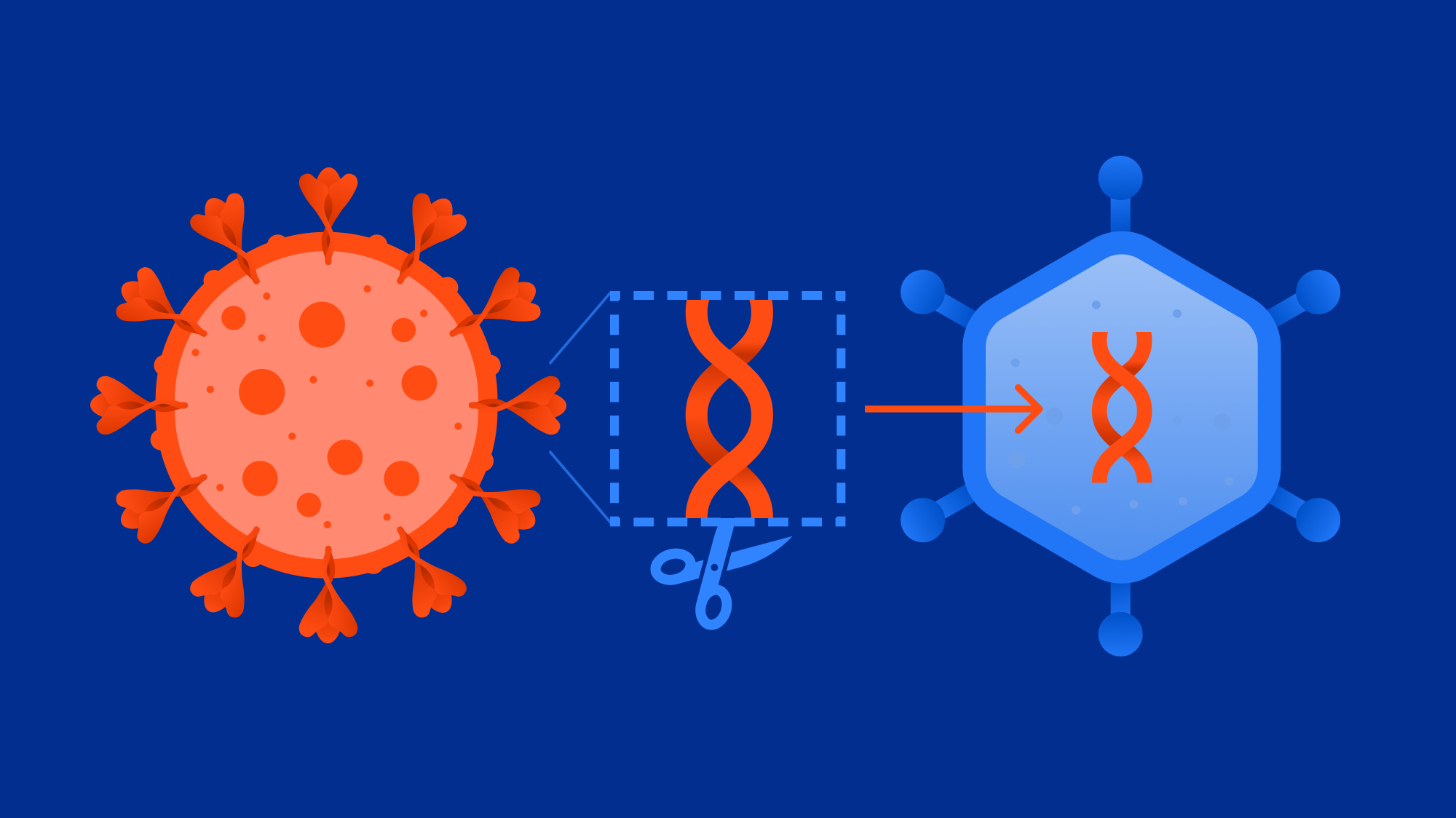
Эти готовые платформы на основе аденовирусных векторов позволяют быстро создавать новые продукты. Можно быстро клонировать ген, который интересен, в данном случае — ген, кодирующий S-белок коронавируса, тот самый шип, который формирует "корону" коронавируса SARS-CoV-2. Этот шип необходимо доставить в организм, чтобы сформировать иммунитет. Синтез гена и его клонирование в вектор — та самая быстрая часть работы. А все, что я говорил до этого про изучение самих аденовирусов, изучение и получение аденовирусных векторов, создание технологической платформы, — это десятки лет. Поэтому это нельзя назвать быстрой историей. Быстрая история началась с момента, когда у нас в руках появилась технологическая платформа.
— Другие вакцины используют либо 26-й аденовирус, либо пятый. А российская вакцина использует и тот и другой. Вы можете более подробно объяснить, как это работает?
— Посмотрите на национальный календарь прививок, вы увидите, что очень многие вакцины бустируются. То есть вы колете вакцину один раз, потом второй, третий и так далее. Для чего это делается? Для того, чтобы сформировать не только высокий иммунный ответ, но и чтобы этот ответ был пролонгированным, чтобы сформировать надежную иммунологическую память. Это такая общебиологическая вещь. Если не считать экономику, а заботиться о здравом смысле, длительности и уровне иммунного ответа, то стратегия прайм-буст иммунизации, то есть использование двух и более вакцинаций, всегда лучше. А делать прайм-буст вакцинацию разными векторами необходимо по простой причине: иммунный ответ после первого введения препарата будет формироваться в том числе и на вектор, если вы будете вводить тот же самый вектор при второй иммунизации, то уже сформированный антивекторный иммунитет будет снижать эффективность вакцинации. Поэтому вы просто меняете вектор-носитель на тот, который иммунный ответ не распознает. Таким образом вам удается незаметно для иммунной системы пронести нужный ген и сформировать иммунный ответ к целевому антигену. В общем-то, вот вся идея, не думаю, что это высокий полет мысли. В первую очередь мы заботились об эффективности и длительности иммунного ответа, и прайм-буст вакцинация различными векторами для этого лучшее решение.
— Ваша вакцина получила временную регистрацию. Что это значит?
— Для чего временная регистрация существует, для чего этот механизм был придуман? Мы же не здоровых добровольцев хотим с вами защищать последующие 1,5 года. Мы можем с вами набирать 40 тысяч, 50 тысяч здоровых добровольцев, которые не попадают в группы риска. То есть тех, кто с высокой вероятностью переболеет легко или вообще не заболеет. Если цель защищать их, то критика, что вакцину нужно изучать долго, обоснована. Если все-таки мы работаем с обычным населением, среди которого есть группы риска, то есть люди, которые в результате перенесенной инфекции или станут инвалидами, или погибнут, то нужен был механизм, который позволит на очень жестких условиях и ограничениях вывести вакцину в оборот в разумные сроки. Что значит жесткие условия? Это значит, что каждая пробирка кодируется QR-кодом. Будет приложение для строгого учета применения вакцины по всем стационарам и для учета всех нежелательных явлений у добровольцев. Каждый доброволец, который проходит вакцинацию, сможет сделать отчет о своем самочувствии в приложении.
Еще хочу подчеркнуть, что речь не идет о принудительной массовой вакцинации, решение о вакцинации каждый принимает для себя сам.
— Сейчас речь идет о каком примерно количестве людей, которые будут участвовать в третьей фазе?
— Окончательные цифры согласовываются, но я могу сказать, что исследования будут включать примерно 30-40 тысяч человек. Конечный, финальный вариант протокола пока не утвержден. Есть идеи и есть понимание, что нужно оценивать в рамках этого исследования. Один из рабочих вариантов подразумевает, что две тысячи человек участвуют в клинических испытаниях по оценке параметров иммуногенности, а 28 тысяч добровольцев участвуют в наблюдательном исследовании для оценки эпидемиологической эффективности. В настоящий момент мы еще дорабатываем протокол, чтобы он соответствовал всем нормам, в том числе международным.
— Чем отличаются друг от друга разные фазы клинических исследований?
— У нас в российском законе не прописаны понятия первой, второй, третьей фазы. Это условное определение, которое используется в международной регуляторике. Первая фаза — это фаза оценки безопасности, ее редко проводят в чистом виде. В ней может участвовать два-восемь-десять-пятнадцать, иногда двадцать человек. В условиях, когда исследуются вакцины, это довольно-таки глупая идея — исследовать добровольцев только на безопасность и при этом не взять кровь и не посмотреть тут же иммуногенность. Поэтому очень часто для вакцин классическую первую фазу делают совместно со второй фазой, на которой проходит оценка не только безопасности, но и эффективности. На этом этапе для вакцин эффективность оценивают по их иммуногенности. То есть на совмещенной первой-второй фазе вы определяете безопасность и иммуногенность по самым разным параметрам, о которых вам говорят регулятор и эксперты. В ходе третьей фазы оценивается эпидемиологическая эффективность. Вы должны оценить, насколько провакцинированная когорта более защищена, чем невакцинированная когорта.
Хочу еще добавить, что к клиническим испытаниям нельзя приступать без успешного прохождения обязательной программы доклинических исследований. Это обширные исследования безопасности и иммуногенности на животных, без которых на людей переходить нельзя. И все параметры обязательно исследуются на большом количестве видов — грызуны, зайцеобразные, обезьяны. Все то, что, собственно, мы сделали перед тем, как было принято решение приступать к клиническим исследованиям. При этом, например, FDA (U.S. Food and Drug Administration, основной американский регулятор в сфере оборота лекарств) говорит, что хорошо исследованные платформенные технологии могут идти по специальной сокращенной процедуре доклинических испытаний. Несмотря на то что наша платформа хорошо изучена, мы успешно прошли полный комплекс доклинических исследований на двух видах приматов, зайцеобразных, мышах, крысах, морских свинках, хомяках. В данном случае мы не пошли по пути FDA. Пошли ли по этому пути Johnson & Johnson, Moderna, AstraZeneca, я не знаю.
— Почему третья фаза исследований будет проводиться уже после временной регистрации?
— Идея и смысл временной регистрации в том, чтобы предоставить возможность доступа к вакцине группам риска и защитить тем самым людей от тяжелых последствий инфекции или от гибели. При этом гражданский оборот вакцины будет осуществляться под жестким контролем, и эта временная регистрация может быть приостановлена в любой момент.
Целью третьей фазы является масштабная оценка безопасности и эффективности на большом количестве добровольцев в рамках контролируемого рандомизированного исследования. Это необходимо для получения большого объема статистических данных по всем параметрам испытаний. Кроме этого, этот этап необходим для принятия решения о постоянной регистрации вакцины.
— В ваш адрес звучала критика от представителей Всемирной организации здравоохранения (ВОЗ), которые говорили, что они не видели никаких научных исследований. Могли бы вы рассказать, есть ли у вас какое-то взаимодействие с представителями ВОЗ?
— В принципе практика такова, что мы сначала предоставляем результаты экспертам Минздрава. Цель была получить безопасную и эффективную вакцину максимально быстро, и это сделано, а потом уже переводить данные на английский язык и писать научные труды. С одной стороны, это не отвлекает людей от поставленной задачи, с другой — это также не оказывает давления на экспертов, которые анализируют полученные нами данные. Когда мы публикуем что-то, то как бы показываем: видите нас, мы опубликовали, нас цитируют и обсуждают — давайте нас регистрируйте. То есть решение публиковать данные после их рассмотрения Минздравом позволяет провести непредвзятую экспертизу. Поэтому сейчас, когда мы зарегистрировали препарат, в ближайшие дни статья на английском языке будет подана в авторитетный международный журнал, она пройдет через экспертную оценку редакторов и рецензентов. Это не один-два дня, этот процесс должен занять какое-то время, но в любом случае весь материал собран, и мы подаем на публикацию. Надеюсь, что в ближайшее время у критиков не будет почвы.
— Испытали ли работники Центра им. Н. Ф. Гамалеи какое-то давление со стороны различных структур власти во время создания вакцины?
— Нет, наши власти только помощь предлагали. Я подчеркну, что разработчик, получая временное удостоверение, попадает в очень тяжелые условия существования под очень жестким контролем со всех сторон. Поэтому нет какой-то, знаете, безудержной радости "ура, мы сделали". Нам нужно тяжело, много работать и выпускать качественный продукт, на нас лежит большая ответственность. И в погоне за количеством доз наш приоритет — не потерять качество, гарантировать, что люди получат правильную, хорошую вакцину. Давить и говорить, сделайте больше и качественнее, — это глупо. Это так не работает, все это понимают, есть определенные производственные мощности, есть загрузка производства. А вот для того, чтобы появилась возможность выпускать больше доз вакцины, президент, правительство, Российский фонд прямых инвестиций (РФПИ), директор нашего института Александр Гинцбург сделали все возможное, чтобы найти финансирование для расширения и наращивания производственных мощностей. Это, наоборот, помощь, это не давление.
— Как вы планируете увеличить производственные мощности?
— Ожидается, что массовое производство вакцины начнется в сентябре 2020 года. К концу 2020 года планируется довести производство вакцины до 200 миллионов доз, если задействовать все производственные площадки, включая международные.
Для этого РФПИ финансирует запуск производства вакцины на базе производственных мощностей своих портфельных компаний "Р-Фарм" и "Биннофарм", входящей в группу компаний "Алиум".
Кроме этого, РФПИ сейчас видит огромный интерес к вакцине в мире и планирует провести независимую от российской третью фазу клинических испытаний в разных странах, в том числе в Саудовской Аравии, ОАЭ, Бразилии и Филиппинах, а также начать массовое производство в ряде стран в партнерстве с локальными суверенными фондами, в том числе в Индии, Южной Корее и Бразилии. Дополнительно прорабатываются возможности производства вакцины в Саудовской Аравии, Турции и на Кубе. Уже более 20 стран выразили заинтересованность в приобретении "Спутника V", в том числе ОАЭ, Саудовская Аравия, Индонезия, Филиппины, Бразилия, Мексика и Индия.
— Ассоциация организаций по клиническим исследованиям (АОКИ) критиковала ученых Центра им. Н. Ф. Гамалеи за то, что они якобы вводили себе прототип своей же вакцины. По их словам, согласно международным стандартам это является грубым нарушением. Как вы реагируете на эту критику?
— Ученые центра не пошли ни на какое нарушение. Ученые центра пошли бы на нарушение, если бы они стали ловить добровольцев на улице и без подписания информированного согласия и страховки вводить им вакцину. Вот это было бы как раз то, о чем говорили АОКИ, если бы мы так делали. Поскольку разработчик имеет право ввести себе то, что он делает, и это не регулируется никак, вводили мы не потому, что мы герои, хотим прославиться, а потому что люди просто работали в "красной зоне", то есть с вирусом. Вся плазма больных коронавирусом в Москве проходила через нас, мы должны были контролировать активность этих плазм в отношении живого вируса, то есть наши сотрудники постоянно были под угрозой. Более того, часть людей — немолодые, часть — с сопутствующими заболеваниями. В общем, история простая: есть возможность защитить ближний круг, существует вакцина, которая создана на всесторонне изученной платформе, и каждый из нас уверен в честности лично своих результатов и результатов коллег. У нас много вакцин, созданных на этой технологической платформе, в том числе зарегистрированных, и никаких сюрпризов мы не ожидали. Мы в первую очередь стремились защитить себя и ближний круг.
Хельсинкская декларация также абсолютно не это регламентирует, она регламентирует порядок проведения клинических исследований. Мы не проводили клинические исследования в тот момент. То есть все их претензии были бы обоснованы, если бы мы проводили клиническое исследование, собрали бы своих людей, вакцинировали и стали бы вносить это в досье о клинических исследованиях. Вот это, конечно, было бы нарушением. На самом деле ничего этого не было, поэтому это просто дешевая подмена понятий.
— Расскажите, пожалуйста, о тестах, которые идентифицируют наиболее эффективные антитела на коронавирус. В чем заключается уникальность этой технологии, какие у вас планы на этот тест, будет ли он получать международный патент?
— Тест основан на ИФА-системе (иммуноферментный анализ), разработанной также в Центре им. Н. Ф. Гамалеи Дмитрием Викторовичем Щебляковым и его лабораторией. Тест основан на определении антител к рецептор-связывающему домену S-белка коронавируса. Дело в том, что большинство, подавляющее большинство, вируснейтрализующих антител, то есть антител, которые напрямую способны инактивировать вирус, формируется именно к этому рецептор-связывающему домену. И с использованием этого теста вы можете определить с высокой вероятностью, что сыворотка крови обладает вируснейтрализующей активностью просто в реакции ИФА, без экспериментов с живым вирусом. Это сильно упрощает историю, так как реакцию вируснейтрализации нужно ставить пять дней, а с помощью этого теста за день, даже за несколько часов в условиях первичного скрининга вы можете отобрать высокоактивные сыворотки или, если речь идет о переливании, высокоактивную плазму. Можете законсервировать эту плазму быстро, то есть не терять донора на пять дней. Дальше вы уже можете проверить образцы в реакции вируснейтрализации в лаборатории, позволяющей работать с живым вирусом, и подтвердить, что эта плазмы или сыворотки активны. То же касается иммунизации, вы можете посмотреть, сколько из всего пула формирующихся в организме антител будут активны в плане нейтрализации вируса.
— Как соотносится уровень антител у тех, кто получил вакцину, и у тех, кто переболел коронавирусом, и что означает это соотношение?
— Во всем мире сейчас сравнивают уровни активности сыворотки у реконвалесцентов, то есть переболевших людей, с уровнем активности у иммунизированных добровольцев. Здесь довольно существенная разница в пользу вакцинированных потому, что при иммунизации нет интоксикации организма, нет тяжелого заболевания, поэтому ничего удивительного, что уровень антител выше у вакцинированных, чем у переболевших. Мы уже знаем, что у очень многих переболевших людей антитела появляются, но потом держатся недолго, а с вакцинацией это гораздо более надежная история.
— Могут ли вашу вакцину получать люди, переболевшие коронавирусом? Возможны ли здесь какие-то нежелательные эффекты?
— Вы знаете, для меня в этом смысле нет абсолютно никаких проблем. Мы же ревакцинируемся каждый год от гриппа, при этом мы им болеем, никто не спрашивает, есть ли здесь проблема, можно на следующий год иммунизироваться, если в этом году болел гриппом. Эти вопросы берут начало от пресловутого ADE-эффекта (антителозависимое усиление инфекции — явление, при котором связывание вируса с не полностью нейтрализующими антителами вызывает его проникновение в иммунные клетки). Об этом явлении сейчас много говорят, но на самом деле в отношении коронавирусов SARS и SARS-CoV-2 после вакцинации векторной вакциной такое усиление не происходит. Если мы говорим о векторных вакцинах, то все вакцинированные выживают и не болеют, все невакцинированные животные умирают или имеют гораздо большие повреждения легких, чем вакцинированные.
Поэтому ни о каком ADE-эффекте в чистом виде, который бы конвертировался в усиление респираторного заболевания, в случае использования векторных вакцин речи не идет. Это не значит, что его не нужно изучать и смотреть. На самом деле разработчики обязаны каждый раз отслеживать свою вакцину в самых разных ситуациях и по самым разным показателям, в том числе и по этому. К этому надо относиться внимательно. Но на сегодняшний день эта история по поводу ADE сильно раздута. Эффект эозинофилии в легких (увеличения количества иммунных клеток, ведущий к так называемому цитокиновому шторму) был показан на инактивированных вакцинах, но не на векторных. Это другой тип вакцин.
И даже иммунизированные инактивированной вакциной животные выживали. У них была эозинофилия, они болели, но выживали. Контрольные животные тоже болели, но умирали. Соответственно, о каком усилении респираторной инфекции может идти речь даже в этом случае? Животные защищены в опыте и не защищены в контрольной группе. Если бы никакой другой вакцины не было и меня бы спросили, хочу ли я приобрести иммунитет, но у меня будет небольшая эозинофилия легких, я бы выбрал эозинофилию. Поэтому это довольно придуманная история. Поскольку на векторных вакцинах это вообще не показано, то раздувать это и превращать в какую-то глобальную проблему — скорее просто поймать кусочек хайпа. Эта история действительно существует в случае с вакциной против лихорадки Денге и других лихорадок. Но для коронавируса это не показано, им уже переболели миллионы людей, никаких случаев ADE-эффекта не нашли. Нет такого, чтобы переболевшие люди заболели еще раз и умерли, как с Денге. На ADE-эффект нужно обращать внимание, нужно отслеживать, для всех вакцин, не только для коронавируса, а от всех респираторных инфекций. Но говорить о том, что это гигантская проблема и теперь есть ADE-эффект и из-за этого никогда не будет вакцины, это глупо. Я не видел ни одной доказательной научной статьи, которая бы рассказывала об этом.
— Как вы могли бы прокомментировать критику, что титр антител в вашей вакцине очень низкий?
— Это либо непонимание терминологии, либо просто подмена понятий. У нас титры огромные. Почти 1 на 15 000. В СМИ перепутали титр вируснейтрализации с титром антител. Все титры указаны в инструкции. Что тут комментировать, если люди не видят титр 1 на 15 000 и пишут 1 на 50. Если бы они написали, что 15 000 — мало, то я бы мог с ними спорить. А поскольку здесь просто подлог и искажение информации, что можно комментировать?
— Есть ли какие-то методологические различия в проведении третьей фазы клинических испытаний в разных странах, которые упускают из виду международные комментаторы, когда говорят о российской вакцине?
— Мы все будем делать по закону Российской Федерации. Я не очень волнуюсь о том, что кто-то прокомментирует, что у нас что-то не так. Все равно найдется кто-то, кто прокомментирует, что у нас что-то не так. Любые клинические исследования в России проводятся по ФЗ № 61. Ни один эксперт, который живет в России, не примет результаты, если они получены с нарушениями. Причем, если есть минимальные отклонения от протокола, они задокументированы и выявляются экспертами, исследование вообще может быть признано несостоявшимся и быть заблокированным. Соответственно, разработчики могут быть привлечены к ответственности в зависимости от масштабов этих нарушений. Мы работаем в правовом поле и экспертизу проводим по законам Российской Федерации. Если кому-то не нравятся законы России, ну это их проблемы.
— Комментаторы указывают на международные стандарты, и хотелось бы понять, как это происходит в других странах, которые разрабатывают эти вакцины. Работают ли они по стандартам и по закону их собственных стран, или по вот этим международным стандартам, которые все предъявляют России?
— На самом деле все стандарты более-менее гармонизированы. Понятно, что многие страны защищают свой рынок, своих производителей, есть условия по регистрации зарубежных препаратов на своей территории. В данном случае Россия не идет каким-то особенным путем. Мы следуем Хельсинкской декларации. Обычно возражения касаются Постановления правительства № 441, где разрешено проводить регистрацию на жестких условиях. Для чего разрешено проводить регистрацию и на каких условиях, мы говорили в начале сегодняшнего разговора. И вся критика сводится только к критике этого пункта и постановления правительства. Но я считаю, что это очень хорошее постановление. Оно на самом деле не развязывает, а завязывает руки производителям, ставит их под жесткий контроль, но при этом дает некую степень свободы. Поэтому я не вижу никаких проблем. Если кому-то хочется критиковать это постановление правительства, здорово. Наверное, хорошо, что в мире есть другое мнение.
— Во время создания российской вакцины работали ли только российские ученые, или в создании вакцины принимали участие какие-то иностранные коллеги?
— Нет, конкретно эта вакцина разрабатывалась только в Центре Гамалеи, ни с какими иностранными коллегами мы не сотрудничали. Но сама технология — это огромный пласт знаний и научного опыта работы. Естественно, с ней в мире работает очень много людей, есть масса публикаций, мы с этими публикациями знакомимся, они — с нашими, это такое общее научное поле. Масса исследований проведена до нас и не нами. Конечно, мы пользовались всеми общедоступными научными результатами, которые есть в этой области. Но непосредственно разработка вакцины, ее создание и масштабирование — это все велось только российскими учеными.