МОСКВА, 4 окт — РИА Новости, Анна Урманцева. Нобелевская премия по химии-2017 присуждена швейцарцу Жаку Дебуши, американцу Йоахиму Франку и представителю Великобритании Ричарду Хендерсону за разработку криоэлектронной микроскопии для определения структуры молекул с высоким разрешением в растворе, так как разработанный ими метод открывает новые возможности в изучении структур белков.
Несмотря на то что первый электронный микроскоп был построен в 30-х годах ХХ века, — и это было настоящим прорывом, поскольку прибор позволял получать изображение объектов с максимальным увеличением до 106 раз, стало понятно, что далеко не все интересные объекты можно с легкостью рассмотреть, ведь для этого их надо было погрузить в вакуум. В СССР данной проблемой занимался член-корреспондент АН СССР, биофизик Николай Киселев, работавший в Институте кристаллографии им. А. В. Шубникова.
Стало ясно, что работы с мелкими объектами, например белками, их необходимо специально обработать. Тогда и был найден метод покрытия их специальным раствором солей тяжелых металлов, под действием которых образец высыхал, а дальше с ним можно было делать что угодно.
Но что значит "посыпать солью" на микроуровне? То же самое, что и на макро. Вся поверхность белка покрывается своеобразным "снегом", что не дает возможности рассмотреть сам белок.
В дальнейшем белки научились кристаллизовать, однако выяснилось, что далеко не все молекулы поддаются кристаллизации. Если взять, например, белки, которые находятся в цитоплазме, то есть в растворенном состоянии, они кристаллизуются хорошо. А вот те, что "сидят" в мембранах клеток, просто разваливаются, если убрать "стенки", то есть мембраны. Поэтому ученые не могли изучить ни одну мембрану, а ведь из них состоят клетки любого живого существа, начиная с бактерий и заканчивая человеком.

Предложенный Жаком Дебуши новый метод криомикроскопии стал большим шагом вперед, а Йоахим Франк и Ричард Хендерсон доработали его. Теперь криомикроскопия проводится так: сначала изучаемый белок помещают в раствор, например в знакомый всем физраствор, который часто применяется в больницах для восстановления у пациента нужного количества внеклеточной жидкости.

Белок в физрастворе устанавливают в специальный витробот — аппарат, где созданы условия для витрификации, то есть перехода жидкости при понижении температуры в стеклообразное состояние. Аппарат изготавливает витрифицированный лед, через который можно наблюдать белок (обычный кристаллический лед для этого не подходит, поскольку меняет структуру белка).
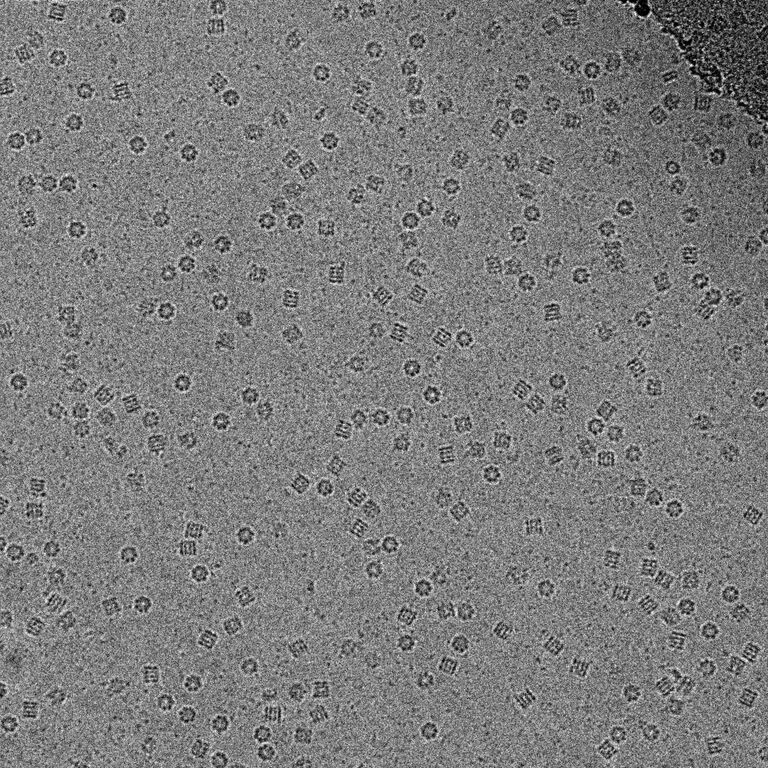
Потом образец падает в газ этан (Ethanum), C2H6, который находится в сжиженном состоянии и представляет из себя жидкость с хорошей теплопроводностью. Тонкие прослойки "буфера" замораживаются (витрифицируются), превращаясь в идеальный лед: абсолютно ровный и с упорядоченным расположением молекул воды. В этом состоянии очень удобно рассматривать белки, которые черным цветом выделяются на фоне серого льда.
С разработкой метода Жака Дебуши, Йоахима Франка и Ричарда Хендерсона появилась возможность анализа структуры белков, которые с трудом поддаются кристаллизации, — ионные каналы, молекулярные машины, вирусы. Это ведет к настоящему прорыву в создании лекарств.
Поясняет доктор биологических наук, профессор РАН, доцент биологического факультета МГУ имени М. В. Ломоносова Ольга Соколова: "Я была уверена, что в этом году Нобелевскую премию по химии дадут Жаку Дебуши, Йоахиму Франку и Ричарду Хендерсону, так и получилось. Еще одно мое предсказание состоит в том, что наш университет не обойдется без современного криоэлектронного микроскопа, поддерживающего эту прорывную технологию для изучения структур белков и других электроннопрозрачных объектов. Очень надеюсь, что скоро мы сможем приступить к изучению структур ионных каналов, теломеразы, транскрипционных комплексов, которые научились получать в очищенном виде на разных факультетах МГУ, используя именно этот метод."