
"Природные антибиотики"
Ученые предлагают новый способ лечения инфекций
В Сколтехе установили один из механизмов, помогающих бактериофагам — вирусам, которые уничтожают бактерии, — бороться с опасными для человека патогенами. Это заметный шаг вперед в разработке альтернативы антибиотикам.
Взлет и упадок антибиотиков
В 1928-м британский микробиолог Александр Флеминг выделил из обыкновенной плесени, которая образуется на лежалом хлебе, вещество, убивающее бактерии. Назвал пенициллином. Так появился первый антибиотик. В 1943-м его запустили в массовое производство.
Это был прорыв в медицине. Раньше эпидемии чумы, холеры, сибирской язвы опустошали целые регионы, а во время войн и стихийных бедствий люди массово погибали от заражения крови и инфицирования ран. Теперь с этим было покончено.
В 1950-70-е фармакологи всех стран активно создавали все новые антимикробные препараты. Казалось, что опасные бактериальные инфекции вот-вот уйдут в прошлое навсегда.
Однако бактерии умеют достаточно быстро, за считанные месяцы, вырабатывать устойчивость (резистентность) к любому антибиотику. Каким бы мощным ни был препарат, среди множества микробов найдутся такие, которые, благодаря определенным мутациям, выживут. Рано или поздно сформируется резистентная популяция и лекарство станет неэффективным.

© HHS/CDC
В последние несколько десятилетий возникли чрезвычайно устойчивые штаммы — супербактерии. По данным ВОЗ, сейчас от них умирает каждый десятый человек в мире. Чаще люди гибнут лишь от болезней сердца и инсульта.
Системы иммунитета бактерий
Поэтому вспомнили про фаготерапию — лечение бактериофагами, то есть собственными вирусами бактерий. Этот метод применяли в 1920-30-е, а потом рассматривали лишь как крайнее средство от полирезистентных бактерий.
И в медицинском мире случился "фаговый ренессанс". Во многих странах создают банки бактериофагов, ученые исследуют различные аспекты взаимодействия бактериальных вирусов с их хозяевами. Цель — модифицировать вирусные частицы так, чтобы конструировать фаги, эффективные против конкретного патогена или группы болезнетворных микроорганизмов.
Для этого нужно понять биологические механизмы, позволяющие бактериям защищаться от вирусных инфекций, а бактериофагам — эту защиту преодолевать. Соответствующие исследования уже несколько лет проводят в Сколковском институте науки и технологий (Сколтехе).
"В последние годы, после того как биоинформатики научились предсказывать новые варианты иммунных систем бактерий, возникло новое направление — микробная иммунология", — говорит руководитель лаборатории анализа метагеномов, кандидат биологических наук Артем Исаев.

1 / 3
Руководитель лаборатории анализа метагеномов Сколтеха Артем Исаев
2 / 3
Руководитель лаборатории анализа метагеномов Сколтеха Артем Исаев
3 / 3
Руководитель лаборатории анализа метагеномов Сколтеха Артем Исаев
Фаги — самые распространенные биологические объекты на Земле. Их примерно в десять раз больше, чем бактерий. В течение всей жизни бактерии вынуждены непрерывно отбивать атаки фагов, поэтому они выработали огромное количество антивирусных стратегий — систем иммунитета. По оценкам ученых — не менее сотни. Одни распространены очень широко и действуют против большой группы вирусов, другие — узкоспециализированные.
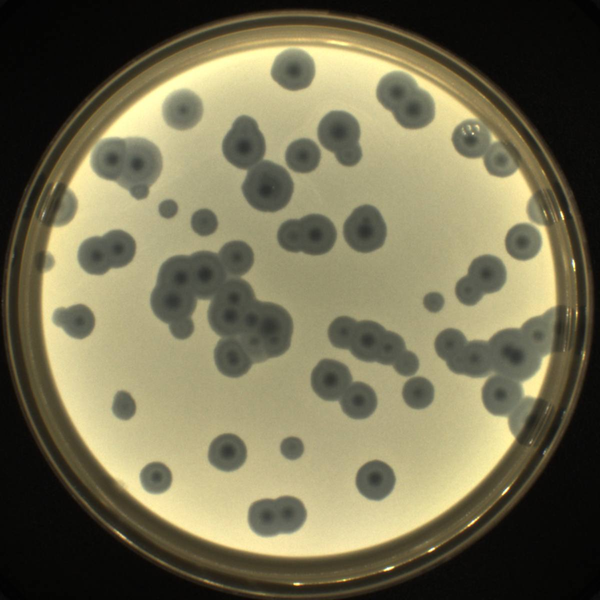
Фаговые бляшки на "газоне" бактерий — места, где микробы погибли в результате вирусной инфекции
© Артем Исаев
"Для большинства молекулярные механизмы пока неясны, но в целом отношения между вирусами и бактериями можно сравнить с гонкой вооружений. Когда у бактерий появляется новая стратегия защиты, это оказывает сильное давление на противоборствующую сторону. Вскоре возникают варианты фагов, которые научились каким-то образом противодействовать иммунитету бактерий. Активная конкуренция приводит к формированию огромного количества противовирусных систем", — поясняет ученый.
Одни не пускают вирус в бактериальные клетки за счет изменения рецепторов на их поверхности, другие уничтожают чужеродную ДНК уже внутри бактерии (системы рестрикции-модификации и исключения суперинфекции). Иногда бактериальная клетка даже идет на самоубийство, чтобы ограничить численность вирусного потомства (система абортивной инфекции).

© Инфографика
Но наиболее впечатляющий пример — система CRISPR/Cas, когда бактерии "записывают" в собственный геном и передают потомству информацию о фагах, с которыми они сталкивались в течение жизни. Такие "воспоминания" позволяют распознавать ДНК фага и эффективно противостоять повторным инфекциям.
"В случае CRISPR бактерия программирует белок Cas на конкретную молекулу ДНК, которая есть только в геноме вируса, — уточняет Исаев. — Похоже на адаптивный иммунитет. Если клетка встроила в свой геном фрагмент ДНК фага, все ее потомки сохранят информацию о встрече с этим патогеном. Своего рода иммунизация на уровне популяции".
С прицелом на Нобелевку
Микробиологи, изучившие систему рестрикции-модификации и предложившие ее использовать в молекулярной генетике, в 1978-м получили Нобелевскую премию по физиологии и медицине. В 2020-м той же чести удостоились ученые, придумавшие, как применять принцип CRISPR/Cas при редактировании генома. В Сколтехе исследуют сразу несколько систем иммунитета бактерий.
"Так что как минимум одна Нобелевка будет, — шутит руководитель лаборатории. — Из новых, еще не изученных систем мы выбираем те, которые нам кажутся самыми интересными, и разбираемся с механизмом их действия, рассматриваем эволюционный аспект — как они возникли и чем полезны бактериям. Вместе с тем мы пытаемся понять, как вирусы обходят бактериальный иммунитет".
Каждая клетка одновременно использует несколько систем иммунитета, и чтобы гарантированно преодолеть такую многослойную линию обороны, потребуется создавать дизайнерские фаги — эффективные сразу против всех систем патогена.
В Сколтехе завершили исследование одного из защитных механизмов бактерий в борьбе с фагами — систему иммунитета BREX (от английского bacteriophage exclusion). Выяснилось, что бактериофаг способен инфицировать бактерии, обладающие BREX-защитой, а также системой рестрикиции-модификации типа I, если он экспрессирует специальный фермент — SAM-лиазу, разрушающий S-аденозилметионин (SAM), важный клеточный метаболит бактериальной клетки.
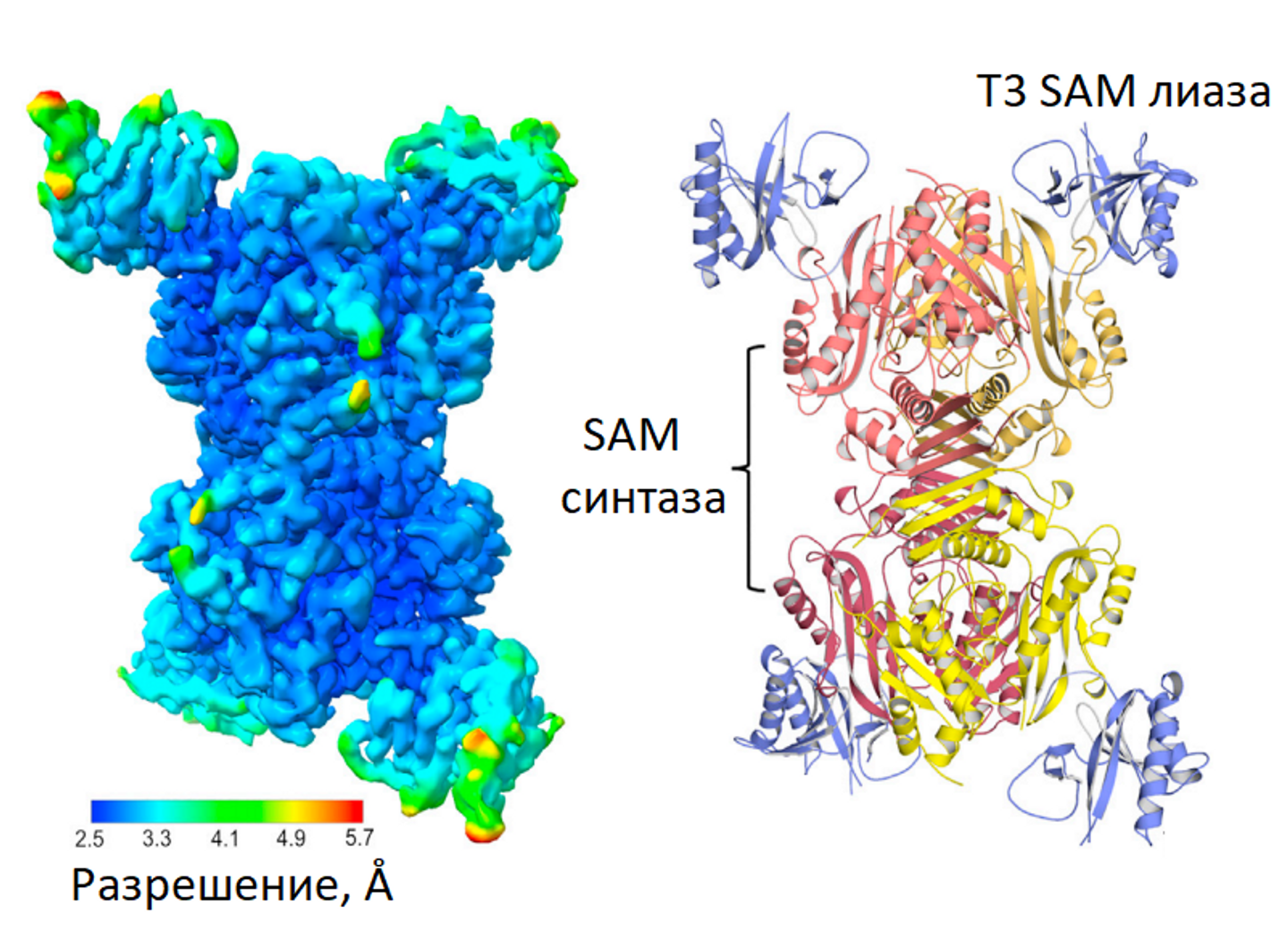
Структура комплекса SAM-лиазы фага Т3 с SAM-синтазой бактерии Escherichia coli
© Артем Исаев
"Мы изучили одну довольно распространенную систему защиты, которая встречается примерно у десяти процентов бактерий, и смогли понять, как конкретный фаг Т3 с антизащитным белком ее преодолевает, — отмечает Исаев. — Теперь мы знаем, что при создании фагов с заданными свойствами в них необходимо встраивать белок, эффективно разрушающий SAM, без которого иммунитет бактерий просто не работает".
"Интересно, что ген, кодирующий SAM-лиазу, стоит первым в генетической последовательности фага Т3. Проникнув в клетку, он сразу решает главную задачу — защищает себя от иммунных систем бактерии. Иначе ДНК вируса очень быстро распознается и уничтожается", — продолжает ученый.

Электроннная микрофотография фага Т3
© Артем Исаев
Найдя брешь в одной из защитных систем бактерий, российские ученые сделали еще один шаг на пути создания новых способов борьбы с опасными инфекциями. Всего в мире вскрыли уже около тридцати таких систем, и работа продолжается.
"Думаю, в течение десяти лет мы увидим практический результат, — говорит исследователь. — Уже заложены основы фаговой терапии нового поколения. Если раньше фаги использовали практически вслепую, не зная механизма их действия, то сейчас мы хотим, чтобы это было безопасно, эффективно и проходило все стадии контроля".
Альтернатива антибиотикам
Клинические испытания фагов провели в ряде стран, в том числе в России. Основной вывод: бактериальные вирусы не вредны для человека. Их можно вводить в кровь, принимать орально, наносить на открытые раны в виде аэрозолей. Они не проникают внутрь клеток человека, не вызывают воспалительных реакций, не нарушают полезную внутреннюю микрофлору.
Но чтобы охарактеризовать даже один вирус, изучить его взаимоотношения с бактериями, нужно проделать огромную работу. Поэтому во многих странах создают банки бактериофагов. В будущем при появлении новой бактерии, устойчивой к антибиотикам, в таком банке буквально за день проведут скрининг и соберут из модулей дизайнерский фаг, способный справиться с любым патогеном.

Лаборатория анализа метагеномов Сколтеха
08:00 28.09.2023
(обновлено: 11:30 28.09.2023)


