https://ria.ru/20190314/1551799453.html
Химики из МГУ разгадали тайну "невозможно быстрой" работы рецепторов глаз
Химики из МГУ разгадали тайну "невозможно быстрой" работы рецепторов глаз - РИА Новости, 14.03.2019
Химики из МГУ разгадали тайну "невозможно быстрой" работы рецепторов глаз
Ученые из МГУ и Дании раскрыли механизм, объясняющий то, почему светочувствительные белки глаз работают внутри колбочек и палочек намного быстрее, чем это... РИА Новости, 14.03.2019
2019-03-14T17:40
2019-03-14T17:40
2019-03-14T17:40
наука
дания
мгу имени м. в. ломоносова
здоровье
химия
зрение
биология
https://cdnn21.img.ria.ru/images/155179/89/1551798961_0:0:2906:1635_1920x0_80_0_0_7ab2c55588148f5f072fc56f319673be.jpg
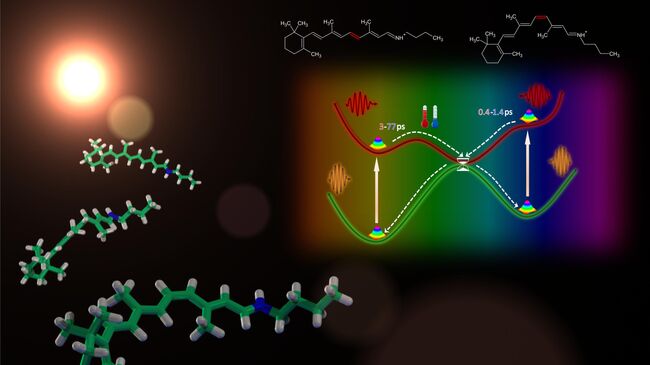
МОСКВА, 14 мар – РИА Новости. Ученые из МГУ и Дании раскрыли механизм, объясняющий то, почему светочувствительные белки глаз работают внутри колбочек и палочек намного быстрее, чем это предсказывают опыты в пробирках. Их выводы были опубликованы в журнале Nature Communications.Глаза людей и многих других млекопитающих содержат в себе два типа светочувствительных клеток – колбочки и палочки. Колбочки позволяют нам различать цвета, но при этом они работают только при достаточно высокой освещенности, а палочки – позволяют видеть силуэты предметов при тусклом свете звезд или Луны.И те, и другие типы рецепторов содержат в себе нити особых белков-опсинов, способных улавливать частицы света и преобразовывать их в электрохимические сигналы. Они представляют собой длинные нити аминокислот, соединенные с молекулами ретиналя – одной из разновидностей витамина А, меняющей пространственную конфигурацию и структуру при столкновении опсина с фотонами.Ученых давно интересует две вещи – почему клетки сетчатки человека и других зрячих живых существ использует только одну из нескольких разновидностей ретиналя, способных реагировать на поглощение фотона белком, и почему эта реакция происходит внутри клетки в 10-100 раз быстрее, чем в пробирке с "очищенными" опсинами.Подобные расхождения, как отмечают Анастасия Боченкова из Московского государственного университета и ее коллеги, заставляли многих ученых подозревать, что в работе светочувствительных белков могут быть замешаны какие-то другие молекулы или компоненты клеток, "помогающие" ретиналю быстрее поменять свою структуру.Российские химики и их датские коллеги нашли ответ на обе этих загадки, создав прибор, который позволил им измерить скорость реакций и проследить за изменениями в форме ретиналя в самом "чистом" виде – не внутри раствора, а в газообразной форме. Для этого ученые распылили молекулы в ионной ловушке и начали обстреливать их сверхкороткими вспышками лазера разных цветов.Полученные в ходе этих замеров данные они обработали при помощи суперкомпьютера "Ломоносов", что позволило химикам определить, с какой скоростью разные типы ретиналя реагируют на облучение светом и совпадают ли эти значения с тем, что происходит в клетках.Как оказалось, его молекулы действительно могут очень быстро менять свою форму – на это уходит около 400 фемтосекунд (миллионных долей наносекунды) для "человеческой" версии ретиналя. Его возврат в оригинальную форму требует почти в 10 раз больше времени, около 3 пикосекунд (тысячных долей наносекунды).Это показывает, что никаких расхождений в скорости работы белков внутри глаз и в пробирке на самом деле нет. Вторая загадка - наличие конкретного типа ретиналя в светочувствительных белках глаз, может объясняться тем, что все возможные виды "обратной" формы этого вещества предрасположены к превращению именно в этот подтип молекулы при взаимодействии со светом.Что интересно, различия в скорости реакции на свет вне клетки и внутри нее были характерны для "бактериального" варианта этого вещества. Это говорит о том, что в работе различных светочувствительных компонентов микробов могут участвовать какие-то другие белки, которые еще предстоит найти и изучить.
https://ria.ru/20170301/1489029851.html
https://ria.ru/20160719/1471564475.html
дания
РИА Новости
internet-group@rian.ru
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2019
РИА Новости
internet-group@rian.ru
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
internet-group@rian.ru
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
internet-group@rian.ru
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
internet-group@rian.ru
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
дания, мгу имени м. в. ломоносова, здоровье, химия, зрение, биология
Наука, Дания, МГУ имени М. В. Ломоносова, Здоровье, Химия, зрение, биология
МОСКВА, 14 мар – РИА Новости. Ученые из МГУ и Дании раскрыли механизм, объясняющий то, почему светочувствительные белки глаз работают внутри колбочек и палочек намного быстрее, чем это предсказывают опыты в пробирках. Их выводы были опубликованы в журнале
Nature Communications. Глаза людей и многих других млекопитающих содержат в себе два типа светочувствительных клеток – колбочки и палочки. Колбочки позволяют нам различать цвета, но при этом они работают только при достаточно высокой освещенности, а палочки – позволяют видеть силуэты предметов при тусклом свете звезд или Луны.
И те, и другие типы рецепторов содержат в себе нити особых белков-опсинов, способных улавливать частицы света и преобразовывать их в электрохимические сигналы. Они представляют собой длинные нити аминокислот, соединенные с молекулами ретиналя – одной из разновидностей витамина А, меняющей пространственную конфигурацию и структуру при столкновении опсина с фотонами.
Ученых давно интересует две вещи – почему клетки сетчатки человека и других зрячих живых существ использует только одну из нескольких разновидностей ретиналя, способных реагировать на поглощение фотона белком, и почему эта реакция происходит внутри клетки в 10-100 раз быстрее, чем в пробирке с "очищенными" опсинами.
Подобные расхождения, как отмечают Анастасия Боченкова из Московского государственного университета и ее коллеги, заставляли многих ученых подозревать, что в работе светочувствительных белков могут быть замешаны какие-то другие молекулы или компоненты клеток, "помогающие" ретиналю быстрее поменять свою структуру.
Российские химики и их датские коллеги нашли ответ на обе этих загадки, создав прибор, который позволил им измерить скорость реакций и проследить за изменениями в форме ретиналя в самом "чистом" виде – не внутри раствора, а в газообразной форме. Для этого ученые распылили молекулы в ионной ловушке и начали обстреливать их сверхкороткими вспышками лазера разных цветов.
Полученные в ходе этих замеров данные они обработали при помощи суперкомпьютера "Ломоносов", что позволило химикам определить, с какой скоростью разные типы ретиналя реагируют на облучение светом и совпадают ли эти значения с тем, что происходит в клетках.
Как оказалось, его молекулы действительно могут очень быстро менять свою форму – на это уходит около 400 фемтосекунд (миллионных долей наносекунды) для "человеческой" версии ретиналя. Его возврат в оригинальную форму требует почти в 10 раз больше времени, около 3 пикосекунд (тысячных долей наносекунды).
Это показывает, что никаких расхождений в скорости работы белков внутри глаз и в пробирке на самом деле нет. Вторая загадка - наличие конкретного типа ретиналя в светочувствительных белках глаз, может объясняться тем, что все возможные виды "обратной" формы этого вещества предрасположены к превращению именно в этот подтип молекулы при взаимодействии со светом.
Что интересно, различия в скорости реакции на свет вне клетки и внутри нее были характерны для "бактериального" варианта этого вещества. Это говорит о том, что в работе различных светочувствительных компонентов микробов могут участвовать какие-то другие белки, которые еще предстоит найти и изучить.