МОСКВА, 11 авг - РИА Новости. Никель в соединении с несколькими органическими молекулами способен "извлекать" водород из других молекул не хуже, чем большинство распространенных платиновых катализаторов, и может стать основой для дешевых и экономически эффективных устройств для получения водорода из воды, заявляют американские ученые в статье, опубликованной в журнале Science.
Водородная энергетика сейчас рассматривается как один из путей преодоления "нефтяной зависимости" и снижения воздействия человека на климат. Одним из препятствий для ее развития остаются большие энергозатраты на получение водорода. В современной практике для этого используются катализаторы на базе палладия или других достаточно дорогих благородных металлов.
Однако катализаторы используют и живые организмы. В частности, некоторые бактерии получают водород с помощью ферменты гидрогеназы. Многие ученые полагают, что искусственный аналог этого белка поможет использовать водород в качестве экологически чистого источника энергии.
Группа химиков под руководством Даниеля Дюбуа (Daniel Dubois) из Тихоокеанской северо-западной национальной лаборатории в Ричленде (США) смогла создать высокоэффективный катализатор на основе никеля, проанализировав структуру и свойства гидрогеназы.
Ученые отмечают, что им удалось не только создать искусственный аналог белка, но и значительно улучшить его свойства - их катализатор работает столь же эффективно, как и платиновые "ускорители" реакции.
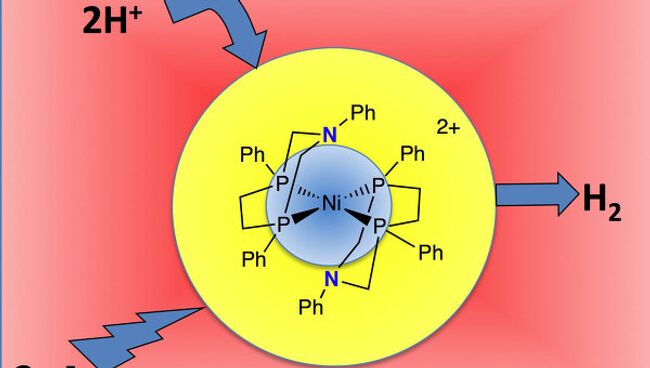
Катализатор Дюбуа построен вокруг иона никеля и состоит из нескольких органических "хвостов", которые переносят ионы водорода к центру реакции. Ион никеля соединяется с двумя "хвостами" при помощи четырех атомов фосфора. На хвостах расположены по два атома азота, к которым в ходе реакции присоединяются ионы водорода. При наличии свободных электронов в среде реакции - в частности, при пропускании электрического тока - ион никеля "присоединяет" их к ионам водорода и формирует из них молекулы нейтрального водорода.
Первые версии катализатора оказались не очень эффективными. При восстановлении водорода объемная молекула "ускорителя" могла соединиться с положительно заряженными ионами водорода тремя различными способами, два из которых приводили к самонейтрализации катализатора - водород восстанавливался, но при этом оставался "прикрепленным" к атомам азота. Ученые несколько модифицировали молекулу и сделали ее относительно плоской - теперь катализатор мог соединяться с водородом только двумя способами, и большинство его молекул не теряло своих свойств с течением времени.
В статье отмечается, что для работы этого катализатора необходима кислая среда, которой может выступить раствор любой органической или минеральной кислоты. Катализатор достаточно устойчив: в нормальных условиях за полчаса реакции разлагается только 5% его молекул. С другой стороны, ученые отмечают, что чрезмерно высокая кислотность среды приводит к быстрому разложению катализатора.
Добавление в раствор воды стабилизирует катализатор и усиливает его способность к реакции: вода способствует повышению концентрации молекул катализатора с "правильной" пространственной структурой, из-за чего его эффективность усиливается. Ученые выяснили, что наиболее благоприятные условия для ускорения реакции возникают тогда, когда воды в растворе в примерно в три раза больше, чем кислоты.
При таких условиях одна молекула катализатора способна выработать 100 тысяч молекул водорода за одну секунду.